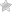Применение аккумуляторов
презентация к уроку по физике (8 класс)

Данная презентация ипользуется при изучении в 8 классе темы” Источники тока”Здесь показаны примеры использования и применения аккумуляторов.
Скачать:
| Вложение | Размер |
|---|---|
| primenenie_akkumulyatora_8_v.pptx | 1.1 МБ |
Предварительный просмотр:
Подписи к слайдам:
Применение аккумуляторов Выполнила Надежда Кузнецова 8в класс МАОУСОШ №15г.Златоуст учитель Кабирова Файруза Рахимовна
Что такое аккумулятор ? Аккумулятор – это источник электрического тока , действие которого основано на химических реакциях . В отличие от обычного гальванического элемента аккумулятор можно заряжать и разряжать большое количество раз. Возможность накопления заряда и возможность перезарядки выделяет аккумуляторы в отдельный класс устройств , широко используемых как на производстве так и в быту.
Портативные устройства Последние годы двадцатого века – это годы широкого распространения так портативных устройств как плееры , пейджеры , сотовые телефоны , различные переносные компьютеры и т.д. В качестве источника для них не только удобно использовать аккумуляторы , но и невозможно использовать что – либо иное. Несмотря на некоторые различи , всем аккумуляторам для портативных устройств присущи много общих свойств: большая емкость , небольшие размеры и масса , высокая надежность. Всем этим требованиям лучшим образом удовлетворяют литий-металл-гидридные аккумуляторы.
Аккумуляторы в автомобилестроении Основное свое применение аккумуляторы нашли в автомобилестроении . В автомобилях в отличие от вышеперечисленных устройств используется свинцовые аккумуляторы из-за простоты и дешевизны .
Аккумулятор в транспорте Аккумулятор широко используют на транспорте, железнодорожные вагоны, троллейбусы, машины – гибриды, электрокары, троллейбусы. И это не привычные аккумуляторные батареи, которые стоят в наших автомобилях и требуют дополнительного сервиса по зарядке и контроль уровня электролита и его плотности. Аккумуляторы использующиеся на транспорте – это тяговые аккумуляторные батареи, разработанные специально для работы силовых агрегатов и двигателей. Такие аккумуляторные батареи обладают продолжительным сроком службы. Тяговым аккумуляторам не страшны постоянные нагрузки и частота зарядки. Гелевый электролит в таких аккумуляторах препятствует выделению газа, что сохраняет срок службы пластин. Кроме того аккумуляторные батареи такого класса защищены от вскипания и работают в режиме заряд – разряд.
Тяговые аккумуляторы Тяговые аккумуляторные батареи используются для оснащения складской техники: штабелеров , погрузчиков, электрокаров и других машин, в условиях, где невозможно использование бензиновых двигателей. Стоит отметить, что срок службы электрокара, гораздо выше, чем у его дизельных аналогов. Для складской техники применяют несколько видов аккумуляторов это свинцово-кислотные аккумуляторные батареи, щелочные аккумуляторы. Однако принято разделять аккумуляторы на два вида – это малообслуживаемые и гелевые аккумуляторные батареи.
Малообслуживаемые аккумуляторы Малообслуживаемые свинцово-малосурьмянистые аккумуляторные батареи являются средним типом батарей, между обслуживаемыми и необслуживаемыми. В принципе, такой тип аккумуляторов также требует специального обслуживания, но при этом не такой требовательный как обслуживаемые аккумуляторы. Из преимуществ отметим низкую стоимость и высокую надёжность. Говоря о недостатках малообслуживаемых аккумуляторов, опять отметим необходимость его контроля и дозаправки, хоть это в меньшей степени, но, тем не менее, требуется. Также не могут похвастаться такие аккумуляторы и сроком своей работы, так как живут они всего 3 года.
Гелевые аккумуляторы Плюсы гораздо менее активная разрядка при использовании большого количества оборудования; быстрая зарядка с использованием зарядного устройства (порядка 2 часов до 100%); восполнение большего количества утраченного заряда при работе генератора; долговечность при соблюдении режимов эксплуатации; отсутствие необходимости обслуживать батарею; работа в любом положении, а также стабильная мощность. Минусы слишком высокая цена, которая делает незначительным преимущество долговечности; очень заметная чувствительность к повышенным токам и моментальное разрушение под их воздействием; необходимость ровного тока при зарядка, иначе гелевый наполнитель расплавится; невозможность использовать долгое время на холоде.
По теме: методические разработки, презентации и конспекты
Творческая работа учащихся по данной теме. Проект состоит из теоретической части, презентации, результов исследования.
Решение задач «Закон Архимеда» Цели урока: Формирование умений вычислять силу Архимеда; показать значение познания мира через мышление; Проверка знаний учащихся по теме «Архимедова си.
Урок по теме « Химические свойства и применение водорода и кислорода»( с применением педтехнологии развития критического мышления). Цель: – Продолжить формирование знаний понятий « степень окисле.
Задачи: -выяснить условия существования электрического тока и дать понятие о видах,устройстве,принципе работы и назначении аккумуляторов.
Цель: A. Образовательный аспект 1. Формирование и развитие СЗУН. К ним относятся: – формирование понятия «Ядерная энергетика» – формирование и накопление знаний в области применении управля.
Презентация предназначена для системы дополнительного образования. Материал можно применить на занятии по радиоэлектроники при изучении темы “Источники питания”.
Материал для изучения темы” Источники тока “в 8 классе.
Реферат Доклад о применении аккумуляторов
Работа добавлена на сайт bukvasha.ru: 2015-10-28
Теоретический лицей « Gaudeamus »
Реферат на тему:
ПРЕПОДАВАТЕЛЬ: БЕЛЯЕВА С.И.
ВЫПОЛНИЛ: ОЧАКОВСКИЙ А. 9 1 кл.
Первым кто открыл возможность получения тока иным, чем электризация трением, способом был итальянский ученный Луиджи Гальвани (1737-1798). Однажды он заметил, что лапка мёртвой лягушки пришла в движение при соприкосновении с её нервом стального скальпеля. Это открытие заставило Гальвани поставить ряд опытов для обнаружения причины возникновения электрического тока.
В основе принципа действия различных типов аккумуляторов лежит явление электролиза , где используется его важное свойство – обратимость. Электролиз – изменение химического состава раствора при прохождении через него электрического тока, обусловленное потерей или присоединением электронов ионами.
Аккумулятор – прибор для накопления электрической энергии с целью её дальнейшего использования.
Аккумулятор можно изготовить аналогично гальваническому элементу, использовав для этой цели две свинцовые пластины, погруженные в раствор содержащий одну часть серной кислоты на пять частей воды. Для зарядки аккумулятора соединяют последовательно два таких элемента и амперметр и пропускают через них ток.
Как только через аккумулятор начинает идти ток, возле катода возникают пузырьки водорода. На аноде, как следовало ожидать, освобождается кислород. Однако его выделением дело не ограничивается. Пластина анода постепенно приобретает темно-коричневый цвет вследствие образования на ее поверхности перекиси свинца ( PbO 2 ) за счет того, что некоторое количество кислорода соединяется химически с материалом пластины. При образовании PbO 2 ток зарядки падает, указывая на возрастание сопротивления аккумулятора. Когда аккумулятор зарядится полностью, присоединяемый к нему вольтметр покажет напряжение несколько более 2 вольт.
В сущности, процесс зарядки состоит в том, что две одинаковые вначале пластины аккумулятора вследствие электролиза становятся разными; одна из них, по-прежнему остаётся свинцовой (-), а материал другой превращается в перекись свинца (+).
Химические реакции в аккумуляторе протекают следующим образом (в процессе зарядки реакции идут слева направо, при разрядке – в обратном направлении):
2 PbSO 4 + 2H 2 O PbO 2 + Pb + H 2 SO 4
При производстве промышленных аккумуляторов положительные пластины покрывают очень толстым слоем перекиси свинца. Отрицательные пластины делают из пористого губчатого свинца.
Напряжение обычной аккумуляторной батареи, состоящей из трех последовательно соединенных аккумуляторов, составляет немногим больше 6 вольт. Коэффициент полезного действия аккумуляторной батареи – около 75%. Цифра указывающая долю запасенной в аккумуляторе электроэнергии проставляется на батарее. Она выражается в ампер-часах . Например 120 ампер-часов. Значит при полной зарядке аккумулятор сможет давать ток в 1 ампер в течение 120 часов, или ток в 2 ампера в течение 60 часов.
Благодаря внутреннему низкому сопротивлению аккумуляторов можно получать очень сильные токи.
Батарею постоянно следует поддерживать в заряженном состоянии частой подзарядкой, даже если она не находится в работе. Зажимы батареи необходимо содержать в чистоте и смазывать вазелином для предотвращения коррозии. Ни в коем случае нельзя допускать замерзания батарей.
Основное применение аккумуляторные батареи имеют для запуска двигателей автомобилей и других машин. Так же их можно использовать как временные источники электроэнергии в отдаленных от населенных пунктов местах. При этом не следует забывать, что аккумуляторы нужно поддерживать в заряженном состоянии (энергия солнца например). В автомобилях будущего аккумуляторы планируется использовать для питания экологически чистых электромоторов.
Л.Эллиот, У.Уилкокс, Физика, Москва 1963, ГИФМЛ, стр. 495
О.Кабардин, Физика, справочные материалы, Москва 1991, «Просвещение», стр. 164
АККУМУЛЯТОР. ПРИМЕНЕНИЕ АККУМУЛЯТОРОВ В ЖИЗНИ Выполнила : Погорелова Евгения 8-А класс. – презентация
Презентация была опубликована год назад пользователемКсения Теперик
Похожие презентации
Презентация на тему: ” АККУМУЛЯТОР. ПРИМЕНЕНИЕ АККУМУЛЯТОРОВ В ЖИЗНИ Выполнила : Погорелова Евгения 8-А класс.” — Транскрипт:
1 АККУМУЛЯТОР. ПРИМЕНЕНИЕ АККУМУЛЯТОРОВ В ЖИЗНИ Выполнила : Погорелова Евгения 8-А класс.
2 Аккумулятор – это прибор для накопления электрической энергии с целью её дальнейшего использования. Простейший аккумулятор состоит из двух свинцовых пластин, помещенных в раствор серной кислоты
3 ТИПЫ И ВИДЫ АККУМУЛЯТОРОВ. В зависимости от вида накапливаемой энергии различают: Электрические; Магнитные; Механические; Тепловые; Световые; Логические.
4 Что такое аккумулятор и для чего он нужен в автомобиле? Аккумулятор представляет собой химический источник тока, который включает в свой состав нескольких элементов питания. Поэтому он также носит название аккумуляторной батареи. Объединение сразу нескольких элементов даёт больший результирующий ток и напряжение. В автомобилях наиболее распространён вид аккумуляторов с 6 элементами (ещё их называют банками) которых выдают напряжение примерно 2.1 вольт. В результате АКБ выдаёт напряжение примерно 12.6 вольт.
5 Первый аккумулятор этого типа разработал французский учёный Гастон Планте, который жил более 150 лет назад.
6 Аккумуляторы с тех пор усовершенствовались, но конструкция и принцип работы АКБ дошли до нас в неизменном виде. Сегодня можно встретить различные виды аккумуляторов, которые отличаются составом электролита и материалами электродов. Наверняка все слышали о никель-кадмиевых батареях, Ni-MH, Li-ion и ряда других. Но в качестве стартерных автомобильных аккумуляторов на сегодняшний день применяются лишь свинцово-кислотные. Объясняется это тем, что этот вид аккумуляторов имеет высокую энергетическую ёмкость. Свинцово- кислотные АКБ могут в течение короткого интервала времени выдавать большой электрический ток. Именно это и требуется для стартера, который прокручивает коленчатый вал при запуске двигателя. И замены этих аккумуляторным батареям пока нет, несмотря на то, свинец и серная кислота (в составе электролита) являются вредными и опасными веществами.
7 КАКИЕ БЫВАЮТ ВИДЫ АККУМУЛЯТОРОВ? Свинцовые аккумуляторы. В этих аккумуляторах реагентом является диоксид свинца и сам свинец, а электролитом раствор серной кислоты. Еще их называют свинцово-кислотными. Разделяют на четыре группы: стационарные, стартерные, портативные (герметизированные) и тяговые. Наибольшее распространение получили стартерные аккумуляторы, их используют для запуска двигателей внутреннего сгорания и обеспечения энергией устройств в машине. Их недостатком можно назвать невысокие значения удельной энергии, не очень хорошую сохранность заряда и выделение водорода. Никель-кадмиевые аккумуляторы. Здесь реагентами выступают гидроксид никеля и кадмий соответственно, а электролитом раствор гидроксида калия, в связи с этим их еще называют щелочными аккумуляторами. Подразделяются на ламельные, безламельные и герметичные. Ламельный никель-кадмиевые аккумуляторы довольно дешевые, характеризуются плоской разрядной кривой, высоким ресурсом работы и прочностью. Применяются для питания шахтных электровозов, подъёмников, средств связи, электронных приборов, стационарного оборудования, для запуска дизелей и авиационных двигателей. Герметичные аккумуляторы характеризуются горизонтальной разрядной кривой, высокой скоростью разряда и способностью работать при низкой температуре, но стоят дороже и обладают эффектом памяти. Применяют их для питания портативной аппаратуры, бытовых приборов, детских игрушек. Большой недостаток этих аккумуляторов заключается в токсичности применяемого кадмия. Никель-железные аккумуляторы. От вышеописанной проблемы ушли используя вместо кадмия железо. Аккумуляторы не содержат токсичный кадмий, дешевле стоят, имеют долгий срок службы и высокую прочность, но из-за выделения водорода в начале заряда производятся только в негерметичном варианте. Характеризуются высоким саморазрядом, низкой отдачей энергии, при температурах ниже -10 градусов практически неработоспособны. В основном их используют как тяговые источники тока в электровозах и промышленных подъемниках.
8 Аккумуляторы, применяемые в качестве элементов питания сотовых телефонов: Никель-кадмиевые (NiCd) (nickel cadmium) Никель-металлогидридные (NiMH) (nickel metal-hydride) Литий-ионные (Li-Ion) (lithium ion) Литий-полимерные (Li-Pol) (lithium polymer) аккумуляторы не будут рассмотрены по причине малой распространённости и отсутствии их точных характеристик, которые в принципе соизмеримы с характеристиками других аккумуляторов на основе лития. Данный вид аккумуляторов набирает популярность благодаря своей некритичности к форме конечного элемента питания.
9 Основное применение аккумуляторные батареи имеют для запуска двигателей автомобилей и других машин.
10 Аккумулятор широко используют на транспорте, железнодорожные вагоны, троллейбусы, машины – гибриды, электрокары, троллейбусы и даже огромные “Белазы” – используют специальные аккумуляторы для движения. И это не привычные аккумуляторные батареи, которые стоят в наших автомобилях и требуют дополнительного сервиса по зарядке и контроль уровня электролита и его плотности. Аккумуляторы использующиеся на транспорте – это тяговые аккумуляторные батареи, разработанные специально для работы силовых агрегатов и двигателей. Такие аккумуляторные батареи обладают продолжительным сроком службы.
11 Тяговым аккумуляторам не страшны постоянные нагрузки и частота зарядки. Гелевый электролит в таких аккумуляторах препятствует выделению газа, что сохраняет срок службы пластин. Кроме того аккумуляторные батареи такого класса защищены от вскипания и работают в режиме заряд – разряд.
Применение аккумуляторов
Развитие технологий изготовления аккумуляторных батарей способствовало тому, что в последние годы все больше технологических решений промышленного применения стали транслироваться в бытовую сферу. Рынок систем альтернативного энергоснабжения в этом случае не явился исключением. Так, необслуживаемые батареи повышенной емкости, произведенные по технологиям AGM и GEL, нашли свое применение в различных видах устройств бытового назначения, таких как:
- Аккумуляторы для источников бесперебойного питания (ИБП)
- Аккумуляторы для скутеров и мотоциклов
- Аккумуляторы для лодочных моторов и эхолотов
Аккумуляторы, выполненные с применением технологий GEL (так называемые гелевые аккумуляторы) и AGM внешне вполне схожи с традиционными свинцово-кислотными, но имеют ряд свойств которые крайне важны при определенных условиях.
Перед тем как рассказать об особенностях гелевых и AGM аккумуляторов следует отметить, что говоря о гелевых аккумуляторах люди даже не подозревают, что речь идет об аккумуляторах выполненных по технологии AGM. Все дело в том, что по качественным характеристикам данные два вида аккумуляторов довольно схожи, но при этом большинство аккумуляторов представленных на российском рынке все же являются AGM –аккумуляторами.
Принцип работы
Гелевые и AGM аккумуляторы относятся к одному классу – свинцово-кислотных батарей. Они состоят из схожего набора составных частей. Обеспечивающий необходимую гермитезацию пластиковый корпус, содержит пластины из свинца или свинцовых сплавов, погруженные в электролит (раствор серной кислоты). Впрочем такое же устройство имеют и традиционные аккумумуляторы. Далее мы расскажем о технологических особенностях которыми отличаются гелевые и AGM аккумуляторы. Основной особенностью гелевых и AGM аккумуляторов является то, что среда в которую помещены свинцовые пластины не выглядит как жидкость а представлена в более густом или менее текучем состоянии. В гелевых аккумуляторах электролит содержит специальные добавки позволяющие получить некую желеобразнию массу (гель), а в AGM аккумуляторах пространство между пластинами заполнено микропористым материалом-сепаратором на основе стекловолокна (дюропластиком), которое в свою очередь пропитано жидким электролитом.
Подробнее на технологических особенностях обоих технологий производства аккумуляторов мы остановимся позже, а сейчас опишем основные преимущества гелевых аккумуляторов и AGM перед традиционными батареями.
Преимущества гелевых аккумуляторов
Высокий ток в цепи, независимо от степени разряда – вот чем характеризуются гелевые и AGM аккумуляторы, и что является важной характеристикой для обеспечения штатной работы лодочного мотора, скутера, а так же стартера автомобиля и мотоцикла. Отсутствие электролита в жидком виде допускает возможность использования гелевых аккумуляторов при любой ориентации в пространстве. Но наиболее важной технической особенностью, выгодно отличающей гелевые аккумуляторы от традиционных свинцово-кислотных батарей – это возможность их работы в режиме глубокого разряда. То есть даже разрядившись до состояния 20-30% от максимального заряда, они способны отдавать электрическую энергию с требуемыми характеристиками, а после подзарядки полностью восстанавливать номинальную емкость. Согласно техническим исследованиям современные гелевые аккумуляторы способны выдержать до 1000 и более циклов глубокого разряда.
Срок службы как AGM, так и гелевого аккумулятора может достигать до 10 лет, при благоприятных условиях эксплуатации.
Кроме того, у AGM и гелевых батарей очень малый ток саморазряда. Заряженная батарея может храниться не подключенной долгое время. Например, за 12 месяцев простоя заряд аккумулятора упадет всего до 80% от первоначального.
В связи с конструктивными особенностями гелевые аккумуляторы менее подвержены влиянию низких температур, что является крайне важной характеристикой при эксплуатации данных батарей в суровом климате урало-сибирского региона.
Применение гелевых и AGM аккумуляторов
Аккумулятор лодочный
Применение гелевых аккумуляторов для яхт, катеров, лодочных моторов обусловлено возможностью отдачи максимального количеством энергии в течении длительного периода, которая обеспечит движение судов вдали от стационарных зарядных станций, сохранит питание систем управления, навигации, жизнедеятельности и комфорта экипажа.
Лодочный аккумулятор приспособлен к ритмичной работе и к ежедневной потере своего заряда до 60%. Он великолепно отдает свою энергию, а потом полностью снова заряжается и все это в условиях повышенной влажности и вибрации.
Лодочные аккумуляторы всегда готовы к работе, не нуждаются в обслуживании и полностью герметичны. Они сделаны с применением кальциевой технологии – ток саморазряда сведён к минимуму. Так же лодочные аккумуляторы обладают высочайшей надёжностью в работе и прочностью к циклам разряда и заряда. Лодочный аккумулятор является особо стойким к вибрации и ударам за счет конструктивных особенностей расположения электролита, а так же прочного и герметичного корпуса сделанного из высокопрочных полимерных материалов.
Компания «Аккумуляторный мир» предлагает большой выбор аккумуляторов для лодок, яхт и катеров в Екатеринбурге.
Покупая лодочные аккумуляторы у нас, Вы получаете качественный товар, который практически не нуждается в обслуживании.
Специалисты нашей компании помогут Вам быстро подобрать именно тот аккумулятор, который необходим Вашему судну.
Аккумуляторы для скутеров
Для того что бы скутер мог уверенно прослужить Вам долгое время, следует обратить внимание на его аккумулятор. Ведь именно от характеристик и параметров аккумулятора будет зависеть качество и скорость передвижения.
Аккумулятор для скутера должен обладать следующими особенностями:
- защита при опрокидывании, возможность эксплуатации аккумулятора в любом положении;
- защищенность от вибраций, герметичность (загущенный электролит не вытекает даже в положении «вверх ногами»);
- очень низкий саморазряд;
- длительный срок службы;
- экстремально высокий стартовый ток благодаря электрическим показателям, намного превышающим установленные стандарты DIN и EN;
- технология AGM (технология с абсорбированным электролитом)
Аккумулятор для ИБП
Аккумулятор для ИБП – это вид батарей применяемых в источниках бесперебойного питания, используемых в случае отсутствия или неудовлетворительного качества питающей сети.
Выбор аккумулятора для ИБП связан с оценкой длительности работы в условиях отключенной электроэнергии. Альтернативой использования батарейного комплекта является использование UPS малого класса, без возможности подключения дополнительных батаpейных модулей.
Определить какие аккумуляторы необходимы для конкретного источника бесперебойного питания – задача достаточно сложная. Для того, чтобы решить ее максимально точно, важно определить, к какому сегменту – в соответствие со своими электрическими и установочными характеристиками – относится аккумулятор, подходящий для Вашего ИБП. После чего следует провести отбор, ориентируясь на условия применения и желаемый срок службы.
Как устроены и работают аккумуляторы
 В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
В широком смысле слова в технике под термином «Аккумулятор» понимается устройство, которое позволяет при одних условиях эксплуатации накапливать определенный вид энергии, а при других — расходовать ее для нужд человека.
Их применяют там, где необходимо собрать энергию за определенное время, а затем использовать ее для совершения больших трудоемких процессов. Например, гидравлические аккумуляторы, используемые в шлюзах, позволяют поднимать корабли на новый уровень русла реки.
Электрические аккумуляторы работают с электроэнергией по этому же принципу: вначале накапливают (аккумулируют) электричество от внешнего источника заряда, а затем отдают его подключенным потребителям для совершения работы. По своей природе они относятся к химическим источникам тока, способным совершать много раз периодические циклы разряда и заряда.
Во время работы постоянно происходят химические реакции между компонентами электродных пластин с заполняющим их веществом — электролитом.
Принципиальную схему устройства аккумулятора можно представить рисунком упрощенного вида, когда в корпус сосуда вставлены две пластины из разнородных металлов с выводами для обеспечения электрических контактов. Между пластинами залит электролит.
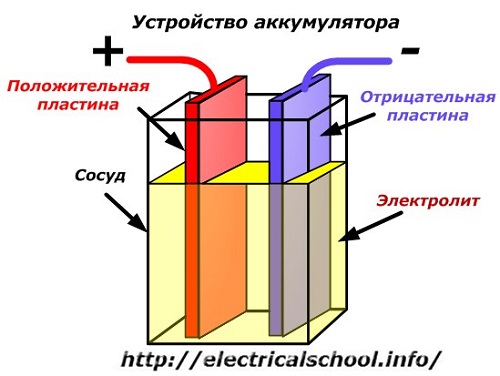
Работа аккумулятора при разряде
Когда к электродам подключена нагрузка, например, лампочка, то создается замкнутая электрическая цепь, через которую протекает ток разряда. Он формируется движением электронов в металлических частях и анионов с катионами в электролите.
Этот процесс условно показан на схеме с никель-кадмиевой конструкцией электродов.
Здесь в качестве материала положительного электрода используют окислы никеля с добавками графита, которые повышают электрическую проводимость. Металлом отрицательного электрода работает губчатый кадмий.
Во время разряда частицы активного кислорода из окислов никеля выделяются в электролит и направляются на отрицательные пластины, где окисляют кадмий.
Работа аккумулятора при заряде
При отключенной нагрузке на клеммы пластин подается постоянное (в определенных ситуациях пульсирующее) напряжение большей величины, чем у заряжаемого аккумулятора с той же полярностью, когда плюсовые и минусовые клеммы источника и потребителя совпадают.
Зарядное устройство всегда обладает большей мощностью, которая «подавляет» оставшуюся в аккумуляторе энергию и создает электрический ток с направлением, противоположным разряду. В результате внутренние химические процессы между электродами и электролитом изменяются. Например, на банке с никель кадмиевыми пластинами положительный электрод обогащается кислородом, а отрицательный — восстанавливается до состояния чистого кадмия.
При разряде и заряде аккумулятора происходит изменение химического состава материала пластин (электродов), а электролита не меняется.
Способы соединения аккумуляторов
Величина тока разряда, которую может выдержать одна банка, зависит от многих факторов, но в первую очередь от конструкции, примененных материалов и их габаритов. Чем значительнее площадь пластин у электродов, тем больший ток они могут выдерживать.
Этот принцип используется для параллельного подключения однотипных банок у аккумуляторов при необходимости увеличения тока на нагрузку. Но для заряда такой конструкции потребуется поднимать мощность источника. Этот способ используется редко для готовых конструкций, ведь сейчас намного проще сразу приобрести необходимый аккумулятор. Но им пользуются производители кислотных АКБ, соединяя различные пластины в единые блоки.
В зависимости от применяемых материалов, между двумя электродными пластинами распространенных в быту аккумуляторов может быть выработано напряжение 1,2/1,5 или 2,0 вольта. (На самом деле этот диапазон значительно шире.) Для многих электрических приборов его явно недостаточно. Поэтому однотипные аккумуляторы подключают последовательно, причем это часто делают в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов.
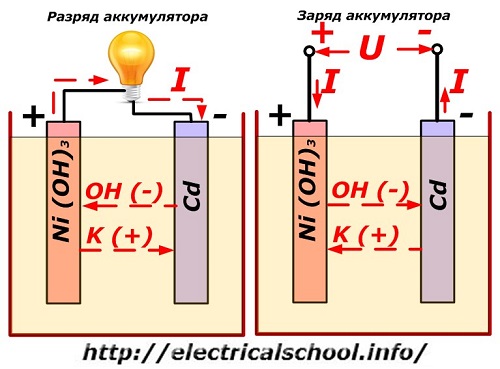
Обычно в народе, особенно среди водителей транспорта, принято называть аккумулятором любое устройство, независимо от количества его составных элементов — банок. Однако, это не совсем правильно. Собранная из нескольких последовательно подключенных банок конструкция является уже батареей, за которой закрепилось сокращенное название «АКБ» . Ее внутреннее устройство показано на рисунке.
Любая из банок состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Соединение пластин в блоки увеличивает их рабочую площадь, снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
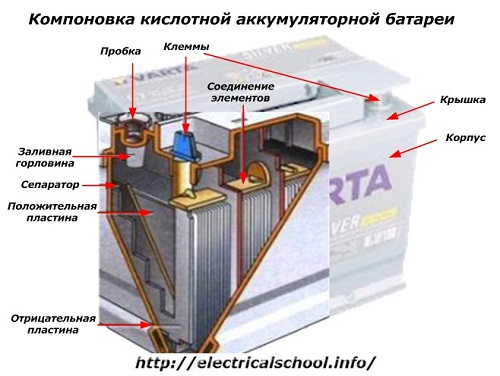
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами (обычно конусной формы) для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». Как правило, для блокировки ошибок при подключении диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки размещена заливная горловина для контроля уровня электролита или доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Поскольку при мощном заряде возможно бурное выделение газов из электролита (а этот процесс возможен при интенсивной езде), то в пробках делаются отверстия для предотвращения повышения давления внутри банки. Через них выходят кислород и водород, а также пары электролита. Подобные ситуации, связанные с чрезмерными токами заряда, желательно избегать.
На этом же рисунке показано соединение элементов между банками и расположение пластин-электродов.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс, сопровождающийся изменением химического состава активной массы электродов с выделением/поглощением в электролит (серную кислоту) воды.
Этим объясняется повышение удельной плотности электролита при заряде и снижение при разряде батареи. Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Входящая в состав электролита кислотных батарей дистиллированная вода при отрицательной температуре переходит в твердое состояние — лед. Поэтому, чтобы автомобильные аккумуляторы не замерзали в холодное время, необходимо применять специальные меры, предусмотренные правилами эксплуатации.
Какие существуют типы аккумуляторов
Современное производство для различных целей выпускает более трех десятков разнообразных по составу электродов и электролиту изделий. Только на основе лития работает 12 известных моделей.

В качестве металла электродов могут встретиться:
Аккумуляторы: виды и происхождение
2. Аккумуляторы: виды и происхождение
Лидирующее положение на рынке по производству аккумуляторов занимает Япония, Тайвань, Китай, Южная Корея, и они постоянно увеличивают масштабы своего «скромного» присутствия на мировом рынке.
На рынке сегодня присутствуют десятки различных конструкций аккумуляторов, и каждая фирма-изготовитель старается достичь оптимального сочетания характеристик — высокой емкости, малых размеров и веса, работоспособности в широком температурном диапазоне и в экстремальных условиях.
В то же время исследования показывают, что более 65% пользователей мобильной и портативной техники хотят иметь еще более емкие аккумуляторы, и они готовы заплатить немалые деньги за возможность пользоваться «машинкой» (или телефоном) в течение нескольких дней без подзарядки. Именно поэтому в большинстве случаев, требуется покупка более емкой батареи, чем идущая в комплекте.
По электрохимической системе аккумуляторы делятся на несколько видов:
– свинцово-кислотные (Sealed Lead Acid, SLA);
В современной портативной электронике свинцовые аккумуляторы уже не используются, поэтому мы начнем наш экскурс с никелевых батарей, все еще применяемых в аккумуляторах для фотоаппаратов, ноутбуков, видеокамер и других устройств.
Родоначальником никелевых аккумуляторов были никель-кадмиевые (Ni-Cd) батареи, изобретенные еще в далеком 1899 году шведским ученым Вальдемаром Юнгнером (Waldmar Jungner). Принцип их работы заключался в том, что никель выступает в качестве положительного электрода (катода), а кадмий в качестве отрицательного (анода). На первых порах это был открытый аккумулятор, в котором кислород, выделяющийся во время заряда, уходил прямиком в атмосферу, что мешало созданию герметичного корпуса и, вкупе с дороговизной необходимых материалов, заметно притормозило начало массового производства.
C 1932 года предпринимались попытки возобновить эксперименты. В то время была предложена идея введения внутрь пористого пластинчатого никелевого электрода из активных металлов, которые обеспечили бы лучшее движение зарядов и значительно снизили бы стоимость производства аккумуляторов.
Но только после второй мировой войны (в 1947 году) разработчики пришли к почти современной схеме герметичных Ni-Cd аккумуляторов. При такой конструкции внутренние газы, выделяющиеся во время заряда поглощались не прореагировавшей частью катода, а не выпускались наружу, как в предыдущих вариантах.
Если по каким-либо причинам (превышение зарядного тока, понижение температуры) скорость анодного образования кислорода окажется выше скорости его катодной ионизации, то резкое повышение внутреннего давления может привести к взрыву аккумулятора. Для предотвращения этого корпус батареи изготавливается из стали, а иногда даже имеется предохранительный клапан.
С тех пор конструкция Ni-Cd батарей существенных изменений не претерпела (рисунок 2).
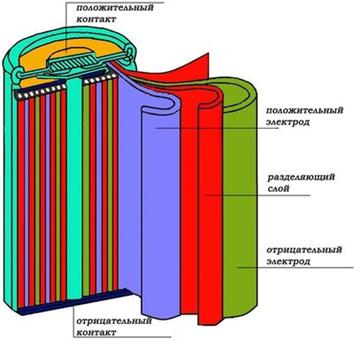
Рисунок 2 – Строение Ni-Cd аккумулятора
Основу любого аккумулятора составляют положительный и отрицательный электроды. В данной схеме положительный электрод (катод) содержит гидрооксид никеля NiOOH с графитовым порошком (5-8%), а отрицательный (анод) — металлический кадмий Cd в виде порошка.
Аккумуляторы этого типа часто называют рулонными, так как электроды скатаны в цилиндр (рулон) вместе с разделяющим слоем, помещены в металлический корпус и залиты электролитом. Разделитель (сепаратор), увлажненный электролитом, изолирует пластины друг от друга. Он изготавливается из нетканого материала, который должен быть устойчив к воздействию щелочи. Электролитом чаще всего выступает гидрооксид калия KOH с добавкой гидроксида лития LiOH, способствующего образованию никелатов лития и увеличения емкости на 20%.
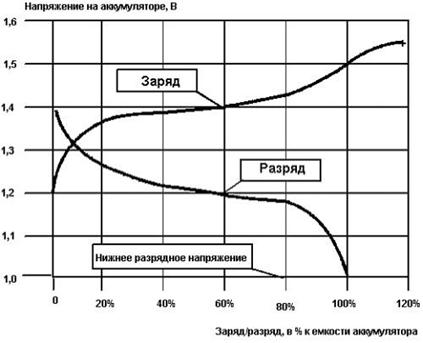
Рисунок 3 – Напряжение на аккумуляторе во время заряда или разряда, в зависимости от текущего уровня зарядки.
Во время разрядки активные никель и кадмий трансформируются в гидрооксиды Ni(OH)2 и Cd(OH)2.
К основным преимуществам Ni-Cd аккумуляторов относятся:
– работа в широком температурном диапазоне и устойчивость к ее перепадам (например, Ni-Cd аккумуляторы могут заряжаться при отрицательной температуре, что делает их незаменимыми при работе в условиях крайнего севера);
– они могут отдавать в нагрузку значительно больший ток, чем другие виды аккумуляторов;
– устойчивость к большим токам заряда и разряда;
– относительно короткое время заряда;
– большое количество циклов «заряда-разряда» (при правильной эксплуатации они выдерживают более 1000 циклов);
– легко восстанавливаются после длительного хранения.
Недостатки Ni-Cd аккумуляторов:
– наличие эффекта памяти — если регулярно ставить не до конца разряженный аккумулятор на зарядку, его емкость будет снижаться за счет роста кристаллов на поверхности пластин и других физико-химических процессов. Чтобы аккумулятор не «отдал концы» раньше времени, хотя бы раз в месяц его необходимо «тренировать», о чем сказано чуть ниже;
– кадмий — очень токсичное вещество, поэтому производство Ni-Cd аккумуляторов плохо сказывается на экологии. Также возникают проблемы с переработкой и утилизацией самих аккумуляторов.
– низкая удельная емкость;
– большой вес и габариты по сравнению с другими типами аккумуляторов при одинаковой емкости;
– высокий саморазряд (после заряда за первые 24 часа работы теряют до 10%, а за месяц — до 20% запасенной энергии).
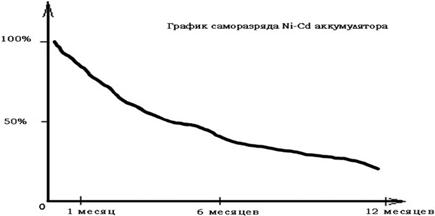
Рисунок 4 – Саморазряд Ni-Cd аккумуляторов
В настоящее время число выпускаемых Ni-Cd аккумуляторов стремительно сокращается, им на смену пришли, в частности, Ni-MH батареи.