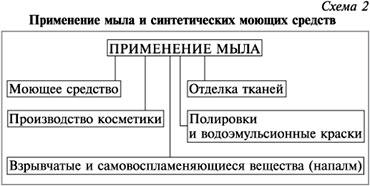
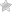Мыло – сообщение по химии 10 класс
Мы́ло — Растворяющаяся в воде моющая масса (кусок или густая жидкость), получаемая соединением жиров и щелочей, используемое либо как косметическое средство — для очищения и ухода за кожей (туалетное мыло); либо как средство бытовой химии — моющее средство (хозяйственное мыло).
Не следует путать с мыльными продуктами, которые изготовляются из синтетических поверхностно-активных веществ, в основном из нефтяных продуктов, лаурил сульфат натрия и т. д.
В последние годы мыло как косметический продукт массового использования всё больше и больше используется в жидком виде. Твёрдое мыло часто используется в виде авторских изделий. В качестве бытовой химии использование мыла с каждым годом сокращается во всем мире: потребители выбирают стиральные порошки, средства для мытья посуды и пр.
1. История
По имеющимся данным, мыло изготовлялось ещё в древних Шумере и Вавилоне (около 2800 г. до н. э.). Описания технологий изготовления мыла найдены в Месопотамии на глиняных табличках, относящихся примерно к 2200 г. до н. э. Египетский папирус середины второго тысячелетия до нашей эры свидетельствует, что египтяне регулярно мылись с помощью мыла. Широко применялись подобные моющие средства и в Древнем Риме.
Легенда гласит, что латинское слово лат. sapo (мыло) произошло от названия горы Сапо в древнем Риме, где совершались жертвоприношения богам. Животный жир, выделяющийся при сжигании жертвы, скапливался и смешивался с древесной золой костра. Полученная масса смывалась дождём в глинистый грунт берега реки Тибр, где жители стирали белье и, естественно, наблюдательность человека не упустила того факта, что благодаря этой смеси одежда отстирывалась гораздо легче. [1]
В 1808 году французский химик Мишель Эжен Шеврёль (1786−1889) по просьбе владельцев текстильной фабрики установил состав мыла. В результате анализа оказалось, что мыло — это натриевая соль высшей жирной (карбоновой) кислоты.
В Европе и США непрерывный процесс мыловарения появился в конце 1930-х годов вместе с непрерывным процессом гидролиза (расщепления) жиров водой и паром высокого давления в мыловаренных башнях.
2. Состав
В химическом отношении основным компонентом твёрдого мыла являются смесь растворимых солей высших жирных кислот. Обычно это натриевые, реже — калиевые и аммониевые соли таких кислот, как стеариновая, пальмитиновая, миристиновая, лауриновая и олеиновая [2] .
Один из вариантов химического состава твёрдого мыла — C17H35COONa (жидкого — C17H35COOK).
Дополнительно в составе мыла могут быть и другие вещества, обладающие моющим действием, а также ароматизаторы и красители.
3. Технология изготовления
В качестве сырья для получения основного компонента мыла могут использоваться животные и растительные жиры, жирозаменители (синтетические жирные кислоты, канифоль, нафтеновые кислоты, талловое масло).
Получение мыла основано на реакции омыления — гидролиза сложных эфиров жирных кислот (то есть жиров) с щелочами, в результате которого образуются соли щелочных металлов и спирты.
В специальных ёмкостях (варочных котлах) нагретые жиры омыляют едкой щёлочью (обычно каустической содой). В результате реакции в варочных котлах образуется однородная вязкая жидкость, густеющая при охлаждении — мыльный клей, состоящий из мыла и глицерина. Содержание жирных кислот в мыле, полученном непосредственно из мыльного клея обычно 40−60 % [2] . Такой продукт имеет название «клеевого мыла». Способ получения клеевого мыла принято называть «прямым методом».
«Косвенный метод» получения мыла заключается в дальнейшей обработке мыльного клея, который подвергают отсолке — обработке электролитами (растворами едкой щёлочи или хлористого натрия), в результате происходит расслоение жидкости: верхний слой, или мыльное ядро, содержит не менее 60 % жирных кислот; нижний слой — подмыльный щёлок, раствор электролита с большим содержанием глицерина (также содержит загрязняющие компоненты, содержавшиеся в исходном сырье). Полученное в результате косвенного метода мыло носит название «ядрового».
Высший сорт мыла — пилированное, получают при перетирании высушенного ядрового мыла на валиках пилирной машины. При этом в конечном продукте содержание жирных кислот повышается до 72−74 %, улучшается структура мыла, его устойчивость к усыханию, прогорканию и действию высоких температур при хранении [3] .
При использовании в качестве щёлочи каустической соды получают твёрдое натриевое мыло. Мягкое или даже жидкое калиевое мыло образуется, когда применяется каустический поташ.
4. Виды мыла
4.1. Хозяйственное мыло
При охлаждении клеевого мыла получается хозяйственное мыло. Твёрдое мыло содержит 40−72 % основного вещества, 0,1−0,2 % свободной щёлочи, 1−2 % свободных карбонатов Na или К, 0,5−1,5 % нерастворимого в воде остатка.
4.2. Самодельное мыло
1. Перевар и обогащение детского мыла.
Бюджетный этап, с которого, как правило, приступают к мыловарению новички. Минус — готовое мыло довольно тугоплавкое и процесс его переваривания долгий. Плюс в том, что в мыло можно добавлять не воду, а отвары трав, что делает его ещё полезнее для кожи, лица или волос (в случае, если это шампуневое мыло).
Технология такова: берётся кусок детского мыла с как можно меньшим количеством отдушек, трётся на тёрке, добавляется вода или иная желаемая жидкость и вся масса ставится на водяную баню. Мыльную массу необходимо греть на маленьком огне, регулярно помешивая. Когда масса станет однородной, её можно снимать с бани и добавлять масла и другие ингредиенты на свой вкус. Вариантов множество: эфирные масла (с соблюдением дозировки по инструкции, как правило в подпункте с пометкой вроде «обогащение косметических средств»), тёртые орехи или молотый кофе, базовые масла (ши, пальмовое, кокосовое и т. п.). В результате этих операций мыло обогащается и делается куда полезней исходника. А также с помощью ароматических масел, отдушек или ароматизаторов можно придать ему желаемый запах.
2. Из мыльной основы.
Наиболее благодатный для творчества материал. Несомненный плюс — в простоте работы с мыльной основой: можно растапливать основу в микроволновой печи, это куда быстрее и для творчества нужнее и полезнее, чем использование водяной бани (однако противники микроволновых печей пользуются той же водяной баней). Мыльные основы бывают разные — различаются по производителям и, конечно, ингредиентам. В магазинах для мыловаров, где представлено несколько видов мыльной основы, вы сможете подобрать наиболее подходящую для вашей творческой задумки. К минусам мыла из мыльной основы можно отнести несколько специфических особенностей:
- хуже мылится, чем промышленные мыла (купленные в магазине), поскольку входящие в состав мыльной основы ингредиенты более щадящие и мягкие;
- по той же причине оно быстрее смыливается, чем промышленный собрат аналогичного веса;
- довольно скользкое.
Даже при перечисленных особенностях вы уловите положительную разницу использования мыла из мыльной основы по сравнению с промышленным мылом.
3. Мыловарение «с нуля».
Самый натуральный и полезный продукт мыловарного дела получается при изготовлении мыла с нуля. Основные ингредиенты — щёлочь, твёрдые масла (т. н. баттеры) и жидкость. Результатом химической реакции, называемой омылением, между основными ингредиентами является действительно мыло в его истинном понимании. При изготовлении мыла с нуля (нулевого мыла, нулёвки — синонимы) вы сами контролируете весь процесс, вы сами выбираете те составляющие, которые нужны вам, вы сами точно знаете, что не станете добавлять что-либо вредное для себя. Разумеется, это является несомненным плюсом. К минусам изготовления мыла с нуля можно отнести необходимость строгого соблюдения техники безопасности, потому что мыловар имеет дело со щёлочью. Прежде чем приступить к мыловарению с нуля, необходима основательная теоретическая подготовка, поскольку совершение некоторых ошибок при неправильном обращении со щёлочью не даёт второго шанса. Однако результат стоит затраченных усилий. Зачастую мыловары, занимающиеся изготовлением мыла с нуля, «не балуются» теми дополнительными красивостями, которые можно получить с мыла из основы, поскольку главное в мыле с нуля — его содержание и его польза, а не форма.
5. Жидкое мыло
5.1. Дозаторы
Дозатор наливного типа (позволяет использовать различные виды жидкого мыла): могут быть установлены в ванных комнатах на предприятиях, в гостиницах, ресторанах, школах, в быту.
Бывают:
Строение мыла (химия мыла)
Строение мыла, его свойства
Мыла – это натриевые или калиевые соли высших жирных кислот (схема 1), гидролизующихся в водном растворе с образованием кислоты и щелочи.
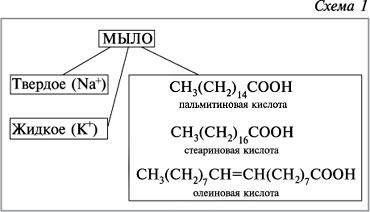
Общая формула твердого мыла:
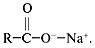
Cоли, образованные сильными основаниями щелочных металлов и слабыми карбоновыми кислотами, подвергаются гидролизу:
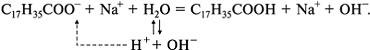
Образовавшаяся щелочь эмульгирует, частично разлагает жиры и освобождает таким образом прилипшую к ткани грязь. Карбоновые кислоты с водой образуют пену, которая захватывает частицы грязи. Калиевые соли по сравнению с натриевыми лучше растворимы в воде и поэтому обладают более сильным моющим свойством.
Гидрофобная часть мыла проникает в гидрофобное загрязняющее вещество, в результате поверхность каждой частицы загрязнения оказывается окруженной оболочкой гидрофильных групп. Они взаимодействуют с полярными молекулами воды. Благодаря этому ионы моющего средства вместе с загрязнением отрываются от поверхности ткани и переходят в водную среду. Так происходит очистка загрязненной поверхности моющим веществом.
Производство мыла состоит из двух стадий: химической и механической. На первой стадии (варка мыла) получают водный раствор натриевых (реже калиевых) солей, жирных кислот или их заменителей.
Получение высших карбоновых кислот при крекинге и окислении нефтепродуктов:
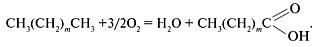
Получение натриевых солей:
Варку мыла заканчивают обработкой мыльного раствора (мыльного клея) избытком щелочи или раствором хлорида натрия. В результате этого на поверхность раствора всплывает концентрированный слой мыла, называемый ядром. Полученное мыло называют ядровым, а процесс его выделения из раствора – отсолкой или высаливанием.
Механическая обработка заключается в охлаждении и сушке, шлифовке, отделке и упаковке готовой продукции.
В результате мыловаренного процесса мы получаем самую разнообразную продукцию, с которой вы можете ознакомиться.
Производство хозяйственного мыла заканчивают на стадии высаливания, при этом происходит очистка мыла от белковых, красящих и механических примесей. Производство туалетного мыла проходит все стадии механической обработки. Наиболее важной из них является шлифовка, т.е. переведение ядрового мыла в раствор кипячением с горячей водой и повторным высаливанием. При этом мыло получается особо чистым и светлым.
Стиральные порошки могут:
• раздражать дыхательные пути;
• стимулировать проникновение в кожу ядовитых веществ;
• вызывать аллергию и дерматит кожи.
Во всех этих случаях необходимо перейти на использование мыла, единственным недостатком которого является то, что оно сушит кожу.
Если мыло варилось из животных или растительных жиров, то из раствора после отделения ядра выделяют образующийся при омылении глицерин, который находит широкое применение: в производстве взрывчатых веществ и полимерных смол, как умягчитель ткани и кожи, при изготовлении парфюмерных, косметических и медицинских препаратов, в производстве кондитерских изделий.
В производстве мыла применяют нафтеновые кислоты, выделяемые при очистке нефтепродуктов (бензина, керосина). С этой целью нефтепродукты обрабатывают раствором гидроксида натрия и получают водный раствор натриевых солей нафтеновых кислот. Этот раствор упаривают и обрабатывают поваренной солью, в результате чего на поверхность раствора всплывает мазеобразная масса темного цвета – мылонафт. Для очистки мылонафта его обрабатывают серной кислотой. Этот нерастворимый в воде продукт называют асидолом или асидол-мылонафтом. Непосредственно из асидола изготовляют мыло.
Производство мыла
Изучение свойства мыла – соли высших карбоновых кислот. Технология их приготовления из смеси пальмитиновой, стеариновой и олеиновой кислот. Образование твердого мыла из натриевых солей и жидких из калиевых. История открытия и развития мыловарения.
| Рубрика | Химия |
| Вид | доклад |
| Язык | русский |
| Дата добавления | 31.10.2016 |
| Размер файла | 15,5 K |

Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Мыло – это соли высших карбоновых кислот. Обычные мыла состоят главным образом из смеси пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, а калиевые соли – жидкие.
Мыла получаются при омылении жиров в присутствии щелочей или серной кислоты. При этом получаются глицерин и высшие карбоновые кислоты. Последним действием щелочи или соды переводят в мыла.
Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и так далее), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно превращают в твердые жиры. Применяются также и заменители жиров – это синтетические карбоновые жирные кислоты с большой молекулярной массой. мыло соль карбоновый кислота
Производство мыла требует больших количеств сырья, именно поэтому поставлена задача получения мыла из непищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Как синтетическое мыло, так и мыло, получаемое из жиров, плохо мылится в жесткой воде. Поэтому наряду с мылом из синтетических кислот производят и моющие средства из других видов сырья (например, из алкилсульфатов – солей сложных эфиров высших спиртов и серной кислоты). Алкилсульфаты содержаться во многих стиральных порошках. А мыла, изготовленные при их помощи, обла дают очень хорошими моющими свойствами. Кальциевые и магниевые соли хорошо растворимы, поэтому такие мыла с легкостью моют и в жесткой воде. Мыло было известно человеку до новой эры летоисчисления. Самое раннее упоминание о мыле в европейских странах встречается у римского писателя и ученого Плиния Старшего (23-79 гг.). В трактате «Естественная история» Плиний писал о способах получения мыла омылением жиров. Мало того, он писал о твердом и мягком мыле, получаемом с использованием соды и поташа соответственно.
Для мытья и стирки белья на Руси использовали щелок, получаемый при обработке золы водой, т.к. зола от сгоревшего топлива растительного происхождения содержит поташ.
Развитию мыловарения способствовало наличие сырьевых источников. Например, марсельская мыловаренная отрасль промышленности, известная с эпохи раннего средневековья, располагала оливковым маслом и содой. Мыловарение развивалось также в Италии, Греции, Испании, на Кипре, т.е. в районах, культивирующих оливковые деревья. Первые германские мыловарни были основаны в XIV столетии.
Химическая сущность мыловаренных процессов долгое время была не ясна. Лишь в конце XVIII в. была выяснена химическая природа жиров, и затем поняты реакции их омыления. В 1779 г. шведский химик К.В.Шееле показал, что при взаимодействии оливкового масла с оксидом свинца и водой образуется растворимое в воде сладкое вещество. В 1817 г. французский химик М.Э.Шеврель открыл стеариновую, пальмитиновую и олеиновую кислоты как продукты разложения жиров при их омылении водой и щелочами. Сладкое вещество, полученное Шееле, было Шеврелем названо глицерином. Сорок лет спустя французский химик П.Э.М.Бертло установил природу глицерина и объяснил химическое строение жиров.
Мыла классифицируют на хозяйственные, туалетные и специальные. Хозяйственными, или стирочными, называют мыла твёрдой консистенции, состоящие в основном из натриевых солей жирных, смоляных (канифольных) и нафтеновых кислот; они могут содержать различные органические и неорганические добавки, улучшающие качество.
По способу приготовления различают ядровые, клеевые и полуядровые мыла. Ядровое мыло – технически чистое мыло, полученное путем высаливания концентрированного мыльного раствора, так называемого мыльного клея, поваренной солью с выделением «ядровой» части. Ядро содержит жирных и подобных кислот не менее 60%.
Клеевым называют мыло, получаемое в результате затвердения мыльного клея в стадии начавшегося разделения его на ядровую и клеевую части, что придаёт готовому продукту мраморную структуру, особенно после добавления ультрамарина; содержит не менее 47% жирных кислот.
Туалетное мыло обладает высоким моющим действием и даёт обильную пену в воде средней жесткости при комнатных температурах; оно должно иметь приятный запах, цвет, форму и не оказывать вредного и раздражающего действия на кожу. Главная масса туалетного мыла вырабатывается из ядрового мыла, в жировую рецептуру которого входит кокосовое масло, после предварительной подсушки, окраски и парфюмирования ароматическими веществами. Для этого подсушенное, замешанное с краской и ароматическими веществами ядровое мыло превращают в тонкую мыльную ленту. Полученные ленты прессуют в плотные и однородные мыльные брусья, их которых штампуют отдельные куски. Туалетное мыло содержит не менее 72% жирных кислот.
К специальным мылам относятся медицинское, содержащие различные лечебные и дезинфицирующие вещества, например сернодегтярное мыло содержит 5,5% серы 2% дёгтя, ихтиоловое с 5% ихтиола и др. к медицинским мылам относится также жидкое калиевое мыло, которое приготовляется из жидких растительных масел путём омыления их едким кали; содержание жирных кислот не менее 40%. Медицинское мыло, применяемое наружно в формах пластырей, мазей, паст, имеет терапевтическое значение в соответствии с влиянием прибавляемого к мылу действующего начала. Таково применение терпентинного мыла в форме мази при ревматизме.
К специальным видам мыла также принадлежат мыла, применяемые большей частью в текстильной, кожевенной, металлургической промышленности, в производстве инсектофунгицидов и т.д. специальные мыла известны главным образом в виде жидких, приготовляемых путём омыления жировой смеси натровыми или калиевыми щелочами или их смесью.
Таким образом, у нас возникает вопрос: почему мыло вообще мылится и моет? Ответ на него прост. Все дело в составе мыла и в особенностях образующих его веществ. В основе любого куска мыла лежат два активных вещества. Во-первых, это переработанный жир растительного или животного происхождения, а во-вторых, особое поверхностно активное вещество (каустик). Кроме этих двух базовых компонентов в состав мыла могут также входить и различные дополнительные ароматизаторы, экстракты трав и цветов, красители, противомикробные вещества и так далее.
При растворении в воде натриевые соли, составляющие основу растительных или животных жиров, проходят процессы с образованием щелочи и кислоты. Они вступают во взаимодействие с грязью, которая находится на намыливаемой поверхности. А образовавшиеся карбоновые кислоты в соединении с водой превращаются в пену. Пена захватывает в себя мельчайшие частички грязи, отрывает их от очищаемой поверхности и просто растворяет в воде. При этом количество ее уменьшается. То есть: чем больше грязи, там меньше мыльной пены. Примерно таким образом мы и избавляемся от всех видов вездесущей грязи.
А это на десерт Несколько интересных фактов:
1) Ежедневно миллионы людей пользуются мылом, ставшим абсолютно необходимым атрибутом жизни современного человека. Мыло было изобретено в Вавилоне приблизительно шесть тысяч лет назад, но кем и когда – точно неизвестно. В основном мыло было жидким, для мытья и бритья пользовались другим мылом. Да и вообще, мыло тех времен, изготавливалось из животного жира, золы и солей щелочи. Однако кроме этого существовала и чистящая паста, которая состояла из хвойных деревьев, воды и эфирного масла.
2) В начале прошлого столетия в США на радио стали выходить в эфир многочасовые передачи с сюжетами про любовь и измену, спонсировали их компании по производству мыла. Отсюда и пошло выражение «мыльная опера».
3) Мыло является и объектом для коллекционирования. Одна из наиболее известных мыльных коллекционеров, Кэрол Вон из Англии, начала собирать ароматные кусочки мыла всех стран еще в 1991 году. Сейчас в ее коллекции более пяти тысяч кусков мыла.
4) Один брусочек самого дорогостоящего мыла в мире привычного размера стоит более четырех тысяч рублей. Это мыло содержит в себе серебро и несколько разновидностей коллагена.
5) Всем известно, что сыр и вино с возрастом становятся лучше. Про мыло можно сказать то же самое. Чем оно старше, тем более нежный аромат имеет, дает больше пены и не вызывает раздражения на коже.
6) В средние века в Англии технология производства мыла была под страшным секретом. Мыловары не могли жить рядом с простыми горожанами и за разглашение тайны мыловарения могли поплатиться жизнью.
7) Король Англии Генрих IV в 1399 году основал организацию, члены который получали разрешение мыться с мылом.
Из всех этих фактов мы можем сделать простой вывод: каким бы не замысловатым и обыденным предметом не казалось нам мыло, оно по-прежнему несет в себе и в своей истории множество тайн, некоторые из которых человечеству так и не удалось раскрыть.
Размещено на Allbest.ru
Подобные документы
Основные критерии классификации видов мыла. Выбор химической основы при изготовлении. Бытовое назначение мыла (туалетное, специальное, хозяйственное). Химическая формула мыла, его физические свойства и механизм действия. История развития мыловарения.
презентация [11,7 M], добавлен 28.01.2016
Основные компоненты и химический состав твердого мыла. Использование косметического средства для очищения и ухода за кожей. Технология изготовления и способы получения натурального мыла. Добавление в него красителей, антисептиков, душистых веществ.
презентация [5,6 M], добавлен 02.03.2015
Классификация и разновидности производных карбоновых кислот, характеристика, особенности, реакционная способность. Способы получения и свойства ангидридов, амидов, нитрилов, сложных эфиров. Отличительные черты непредельных одноосновных карбоновых кислот.
реферат [56,0 K], добавлен 21.02.2009
Ознакомление с классификацией и разновидностями карбоновых кислот, их главными физическими и химическими свойствами, сферах практического применения. Способы и приемы получения карбоновых кислот, их реакционная способность. Гомологический ряд и гомологи.
разработка урока [17,9 K], добавлен 13.11.2011
Ацильные соединения – производные карбоновых кислот, содержащие ацильную группу. Свойства кислот обусловлены наличием в них карбоксильной группы, состоящей из гидроксильной и карбонильной групп. Способы получения и реакции ангидридов карбоновых кислот.
реферат [174,1 K], добавлен 03.02.2009
Строение предельных углеводородов, их физические и химические свойства. Гомологический ряд метана. Изомерия и номенклатура предельных углеводородов. Декарбоксилирование натриевых солей карбоновых кислот. Выделение углеводородов из природного сырья.
презентация [46,7 K], добавлен 28.11.2011
Карбоновые кислоты — более сильные кислоты, чем спирты. Ковалентный характер молекул и равновесие диссоциации. Формулы карбоновых кислот. Реакции с металлами, их основными гидроксидами и спиртами. Краткая характеристика физических свойств кислот.
презентация [525,6 K], добавлен 06.05.2011
Резонансные структуры производных карбоновых кислот. Галогенангидриды, их главные свойства. Ангидриды и кетены, амиды. Нитрилы как органические соединения с тройной связью. Сложные эфиры, реакции a-углеродного атома. Свойства ацетоуксусного эфира.
контрольная работа [627,9 K], добавлен 05.08.2013
Графическое изображение формул солей. Названия, классификация солей. Кислые, средние, основные, двойные, комплексные соли. Получение солей. Реакции: нейтрализации, кислот с основными оксидами, оснований с кислотными оксидами, основных и кислотных оксидов
реферат [69,9 K], добавлен 27.11.2005
Общее определение сложных эфиров алифатичеких карбоновых кислот. Физические и химические свойства. Методы получения сложных эфиров. Реакция этерификации и ее стадии. Особенности применения. Токсическое действие. Ацилирование спиртов галогенангидридами.
реферат [441,9 K], добавлен 22.05.2016

Работы в архивах красиво оформлены согласно требованиям ВУЗов и содержат рисунки, диаграммы, формулы и т.д.
PPT, PPTX и PDF-файлы представлены только в архивах.
Рекомендуем скачать работу.
Мыла, их свойства. Синтетические моющие средства
Омыление — это гидролиз сложных эфиров под действием щёлочи. При этом получается соль органической кислоты и спирт. Исторически это название пошло от процесса получения мыла — гидролиза жиров щёлоком, при котором получается смесь солей высших жирных кислот (собственно — мыло) и глицерин (трёхатомный спирт).
Соответственно омыление — это реакция сложного эфира со щелочью.
 До изобретения мыла жир и грязь с кожи удаляли золой и мелким речным песком.Технология изготовления мыла из животных жиров складывалась на протяжении многих веков. Посмотрим, как можно приготовить мыло в химической лаборатории. Сначала составляется жировая смесь, которую расплавляют и омыляют – варят со щелочью. Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи. Сюда же добавляют поваренную соль и нагревают полученную смесь. При этом образуются мыло и глицерин. Соль добавляют для осаждения глицерина и загрязнений. Также получают мыло в промышленности.
До изобретения мыла жир и грязь с кожи удаляли золой и мелким речным песком.Технология изготовления мыла из животных жиров складывалась на протяжении многих веков. Посмотрим, как можно приготовить мыло в химической лаборатории. Сначала составляется жировая смесь, которую расплавляют и омыляют – варят со щелочью. Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи. Сюда же добавляют поваренную соль и нагревают полученную смесь. При этом образуются мыло и глицерин. Соль добавляют для осаждения глицерина и загрязнений. Также получают мыло в промышленности.
Состав мыла
Мыла – натриевые или калиевые соли высших карбоновых кислот (кислот, содержащих в своем составе более 10 атомов углерода), полученных в результате гидролиза жиров в щелочной среде (чаще всего из жиров, содержащих в составе стеариновую кислоту С17Н35СООН) — С17Н35СООNa – стеарат натрия.
Жир + щелочь = соли жирных кислот и глицерин.
Свойства мыла
Поверхностный слой дистиллированной воды находится в натянутом состоянии подобно упругой пленке. При добавлении мыла и некоторых других растворимых в воде веществ поверхностное натяжение воды уменьшается. Мыло и другие моющие вещества относят к поверхностно-активным веществам (ПАВ). Они уменьшают поверхностное натяжение воды, усиливая тем самым моющие свойства воды.

Молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии и поэтому стремятся втянуться внутрь так, что при этом на поверхности остается минимальное количество молекул. За счет этого вдоль поверхности жидкости всегда действует сила, стремящаяся сократить поверхность. Это явление в физике получило название поверхностного натяжения жидкости.
 Молекулы ПАВ на пограничной поверхности располагаются так, что гидрофильные группы карбоксильных анионов направлены в воду, а углеводородные гидрофобные выталкиваются из нее. В результате поверхность воды покрывается частоколом из молекул ПАВ. Такая водная поверхность имеет меньшее поверхностное натяжение, что способствует быстрому и полному смачиванию загрязненных поверхностей. Уменьшая поверхность натяжения воды, мы увеличиваем ее смачивающую способность.
Молекулы ПАВ на пограничной поверхности располагаются так, что гидрофильные группы карбоксильных анионов направлены в воду, а углеводородные гидрофобные выталкиваются из нее. В результате поверхность воды покрывается частоколом из молекул ПАВ. Такая водная поверхность имеет меньшее поверхностное натяжение, что способствует быстрому и полному смачиванию загрязненных поверхностей. Уменьшая поверхность натяжения воды, мы увеличиваем ее смачивающую способность.
Секрет очищающего действия мыла

 СМС (синтетические моющие средства) – натриевые соли синтетических кислот (сульфокислот, сложных эфиров высших спиртов и серной кислоты).
СМС (синтетические моющие средства) – натриевые соли синтетических кислот (сульфокислот, сложных эфиров высших спиртов и серной кислоты).
Рассмотрим свойства моющих веществ и сравним мыла и СМС (стирального порошка) . Для начала проверим, какая среда характерна для наших моющих средств. Как мы это сделаем?
С помощью индикаторов.
Будем использовать известные нам индикаторы – лакмус и фенолфталеин. При добавлении лакмуса в раствор мыла и в раствор СМС он приобретает синий цвет, а фенолфталеин – малиновый, то есть реакция среды щелочная.
А что происходит с мылом и СМС в жесткой воде? (понятно, почему мыловары не варят мыло на водопроводной воде, а используют отвары, дистиллированную воду, молоко и тд.)
Добавим в одну пробирку раствор мыла, а в другую раствор СМС, взболтаем их. Что вы наблюдаете? В эти же пробирки добавим хлорид кальция и взболтаем содержимое пробирок. Что вы наблюдаете теперь? Раствор СМС пенится, а в растворе мыла образуются нерастворимые соли:
2С17Н35СОО – + Са 2+ = Са(С17Н35СОО)2
А СМС образуют растворимые соли кальция, которые также обладают поверхностно-активными свойствами.
Использование чрезмерного количества этих средств приводит к загрязнению окружающей среды. Послушаем сообщение об экологических последствиях использования ПАВ.
Многие ПАВ трудно поддаются биологическому разложению. Поступая со сточными водами в реки и озера, они загрязняют окружающую среду. В результате образуются целые горы пены в канализационных трубах, реках, озерах, куда попадают промышленные и бытовые стоки. Использование некоторых ПАВ приводит к гибели всех живых обитателей в воде.
Почему раствор мыла, попадая в реку или озеро, быстро разлагается, а некоторые ПАВ нет? Дело в том, что мыла, полученные из жиров, содержат неразветвленные углеводородные цепи, которые разрушаются бактериями. В то же время в состав некоторых СМС входят алкилсульфаты или алкил(арил)сульфонаты с углеводородными цепями, имеющими разветвленное или ароматическое строение. Такие соединения бактерии «переварить» не могут. Поэтому при создании новых ПАВ необходимо учитывать не только их эффективность, но и способность к биологическому распаду – уничтожению некоторыми видами микроорганизмов.
§ 13. Сложные эфиры. Жиры. Мыла
Как вы уже знаете, общим способом получения сложных эфиров является процесс, называемый реакцией этерификации. Еще раз напомним, как записывают уравнение этой реакции в общем виде:

| Сложными эфирами называют производные карбоновых кислот, в которых атом водорода карбоксильной группы замещен на углеводородный радикал. Их состав соответствует общей формуле |
Эта реакция обратима. Продукты реакции могут взаимодействовать друг с другом с образованием исходных веществ — спирта и кислоты. Таким образом, реакция сложных эфиров с водой — гидролиз сложного эфира — обратна реакции этерификации. Химическое равновесие, устанавливающееся при равенстве скоростей прямой (этерификации) и обратной (гидролиз) реакций, может быть смещено в сторону образования эфира с помощью водоотнимающих средств, например с помощью концентрированной серной кислоты, а в сторону гидролиза сложного эфира — в присутствии щелочи.
Сложные эфиры широко распространены в природе. Специфический аромат ягод, плодов и фруктов в значительной степени обусловлен представителями этого класса органических соединений (рис. 57).

Рис. 57.
Сложные эфиры в природе
Сложные эфиры жирных кислот и спиртов с длинными углеводородными радикалами называют восками.
Сложные эфиры находят широкое применение в технике и различных отраслях промышленности. Они являются хорошими растворителями органических соединений. Их плотность меньше плотности воды, и они практически не растворяются в ней. Так, сложные эфиры с относительно небольшой молекулярной массой представляют собой легковоспламеняющиеся жидкости с невысокими температурами кипения, имеют запахи различных фруктов. Их применяют как растворители лаков и красок, ароматизаторы изделий пищевой промышленности (рис. 58).

Рис. 58.
Применение сложных эфиров:
1 — лекарственные средства; 2, 3 — парфюмерия и косметика; 4 — синтетические и искусственные волокна; 5 — лаки; 6 — производство напитков и кондитерских изделий
Важнейшими представителями природных сложных эфиров являются жиры (рис. 59).

| Жиры — это сложные эфиры трехатомного спирта глицерина и высших карбоновых кислот. |
Состав и строение жиров могут быть отражены общей формулой

где R, R’, R”— радикалы, входящие в состав высших карбоновых кислот: масляной (—С3Н7), пальмитиновой (—С15Н31), стеариновой (—С17Н35), олеиновой (—С17Н33), линолевой (—С17Н31) и др.
В состав жиров могут входить остатки предельных и непредельных кислот, содержащих четное число атомов углерода и неразветвленный углеродный скелет (рис. 60). Природные жиры, как правило, являются смешанными сложными эфирами, т. е. их молекулы образованы различными карбоновыми кислотами.

Рис. 60.
Масштабная модель молекулы жира (тристеарата)
Жиры, образованные предельными кислотами (масляной, пальмитиновой, стеариновой и др.). имеют, как правило, твердую консистенцию. Это жиры животного происхождения (исключение составляет жидкий рыбий жир). С увеличением длины углеводородного радикала температура плавления жира увеличивается. Если в составе жира содержатся остатки непредельных кислот (олеиновой и линолевой), они представляют собой вязкие жидкости, которые часто называют маслами. Масла — это жидкие жиры растительного происхождения (исключением является твердое пальмовое масло): льняное, конопляное, подсолнечное, оливковое, соевое, кукурузное и др.
Жиры нерастворимы в воде, но хорошо растворяются в органических растворителях — бензоле, гексане.
Состав жиров определяет их физические и химические свойства. Следует ожидать, что для жиров, содержащих остатки непредельных карбоновых кислот, характерны все реакции этого типа соединений. Они обесцвечивают бромную воду, вступают в другие реакции присоединения. Из них наиболее важная в практическом плане реакция — это гидрирование жиров.
Гидрированием жидких жиров получают твердые сложные эфиры. Именно эта реакция и лежит в основе получения из растительного масла твердого жира — маргарина. Условно этот процесс можно описать уравнением реакции, например:

Все жиры, как и другие сложные эфиры, подвергаются гидролизу. Например:

Напомним, что гидролиз сложных эфиров — обратимая реакция. Для смещения равновесия в сторону продуктов гидролиза его проводят в щелочной среде (в присутствии щелочей или карбонатов щелочных металлов, например соды Na2CO3). При этом гидролиз протекает необратимо и приводит в результате к образованию не карбоновых кислот, а их солей, которые называют мылами.
Поэтому гидролиз жиров в щелочной среде называют омылением жиров.
При омылении жиров образуются глицерин и мыла — натриевые или калиевые соли высших карбоновых кислот.
Изготовление мыла — один из самых древних химических синтезов. Конечно, этот процесс гораздо «моложе», чем получение этилового спирта. Когда германские племена во времена Цезаря варили козье сало с поташем (техническое название карбоната калия), вымытым из пепла костров, они проводили ту же самую реакцию, которая осуществляется сейчас в грандиозных масштабах современными мыловарами, а именно — щелочной гидролиз жиров (омыление):

Мыло, которое мы используем, представляет собой смесь солей, поскольку жир, из которого его получают, содержит остатки различных кислот. Натриевые соли высших кислот RCOONa имеют твердое агрегатное состояние, а калиевые RCOOK — жидкое (жидкое мыло). При изготовлении мыла в него добавляют душистые вещества, глицерин, красители, антисептики, растительные экстракты. Однако с химической точки зрения все мыла одинаковы (диссоциируют как сильные электролиты согласно уравнению RCOONa → RCOO – + Na + ) и природа их действия во всех случаях одна и та же.
Очищающее действие мыла — сложный процесс. Молекула соли высшей карбоновой кислоты имеет полярную ионную часть (—COO – Na + ) и неполярный углеводородный радикал, содержащий 12—18 атомов углерода. Полярная часть молекулы растворима в воде (гидрофильна), а неполярная — в жирах и других малополярных веществах (гидрофобна) (рис. 61).

Рис. 61.
Модель молекулы стеарата натрия в воде
В обычных условиях частицы жира или масла слипаются между собой, образуя в водной среде отдельную фазу. В присутствии мыла картина резко изменяется. Неполярные концы молекулы мыла погружаются в капли масла, а полярные карбоксилат-анионы остаются в водном растворе. В результате отталкивания одноименных зарядов на поверхности масла оно разбивается на мельчайшие частицы, каждая из которых имеет ионную оболочку из анионов —СОО – . Наличие этой оболочки препятствует слиянию частиц, в результате чего образуется устойчивая эмульсия масла в воде. Эмульгирование жира, содержащего грязь, обусловливает очищающее действие мыла (рис. 62).

Рис. 62.
Эмульгирование масла в воде в присутствии жира
В жесткой воде, содержащей ионы Са 2+ и Mg 2+ , мыло теряет свою моющую способность. Это происходит в результате того, что кальциевые и магниевые соли высших карбоновых кислот нерастворимы в воде:

Вместо пены в воде образуются хлопья осадка, и мыло расходуется бесполезно.
Этого недостатка лишены синтетические моющие средства (рис. 63) — современные стиральные порошки.

Рис. 63.
Синтетические моющие средства
Принцип действия синтетических моющих средств точно такой же, как и у мыла, однако они имеют значительные преимущества. Во-первых, их растворы имеют нейтральную, а не щелочную среду. Во-вторых, синтетические моющие средства сохраняют свое действие в жесткой и даже морской воде, поскольку их кальциевые и магниевые соли растворимы. Вместе с тем остатки стиральных порошков в сточных водах очень медленно разлагаются биологическим путем и вызывают загрязнение окружающей среды.
Мыло – сообщение по химии 10 класс
До изобретения мыла жир и грязь с кожи удаляли золой и мелким речным песком. Египтяне умывались смешанной с водой пастой на основе пчелиного воска. В Древнем Риме при мытье пользовались мелко истолченным мелом, пемзой, золой. Видимо, римлян не смущало, что при таких омовениях вместе с грязью можно было «соскоблить» и часть самой кожи. Заслуга в изобретении мыла принадлежит, вероятно, галльским племенам. По свидетельству Плиния Старшего, из сала и золы букового дерева галлы делали мазь, которую применяли для окрашивания волос и лечения кожных заболеваний. А во II веке ее стали использовать в качестве моющего средства.
Христианская религия считала мытье тела делом «греховодным». Многие «святые» были известны только тем, что всю свою жизнь не умывались. Но люди давно заметили вред и опасность для здоровья загрязнения кожи. Уже в 18 веке на Руси было налажено мыловарение, а в ряде европейских стран еще раньше.
Технология изготовления мыла из животных жиров складывалась на протяжении многих веков. Сначала составляется жировая смесь, которую расплавляют и омыляют – варят со щелочью. Для гидролиза жира в щелочной среде берется немного топленого свиного сала, около 10 мл этилового спирта и 10 мл раствора щелочи. Сюда же добавляют поваренную соль и нагревают полученную смесь. При этом образуются мыло и глицерин. Соль добавляют для осаждения глицерина и загрязнений. В мыльной массе образуется два слоя – ядро (чистое мыло) и подмыленный щелок.
Также получают мыло в промышленности.

Омыление жиров может протекать и в присутствии серной кислоты (кислотное омыление). При этом получаются глицерин и высшие карбоновые кислоты. Последние действием щелочи или соды переводят в мыла. Исходным сырьем для получения мыла служат растительные масла (подсолнечное, хлопковое и др.), животные жиры, а также гидроксид натрия или кальцинированная сода. Растительные масла предварительно подвергаются гидрогенизации, т. е. их превращают в твердые жиры. Применяются также заменители жиров — синтетические карбоновые жирные кислоты с большой молекулярной массой. Производство мыла требует больших количеств сырья, поэтому поставлена задача получения мыла из не пищевых продуктов. Необходимые для производства мыла карбоновые кислоты получают окислением парафина. Нейтрализацией кислот, содержащих от 9 до 15 углеродных атомов в молекуле, получают туалетное мыло, а из кислот, содержащих от 16 до 20 атома углерода, — хозяйственное мыло и мыло для технических целей.

Обычные мыла состоят главным образом из смеси солей пальмитиновой, стеариновой и олеиновой кислот. Натриевые соли образуют твердые мыла, калиевые соли — жидкие мыла.
Мыло – натриевые или калиевые соли высших карбоновых кислот,
полученные в результате гидролиза жиров в щелочной среде

Строение мыла можно описать общей формулой:
где R – углеводородный радикал, M – металл.
Твёрдое мыло — R COONa
Жидкое мыло – R COOK
а) простота и удобство в использовании;
б) хорошо удаляет кожное сало
в) обладает антисептическими свойствами
Недостатки мыла и их устранение:
1. Плохая моющая способность в жесткой воде, содержащей растворимые соли кальция и магния. Так как при этом выпадают в осадок нерастворимые в воде соли высших карбоновых кислот кальция и магния. Т.е. при этом требуется большой расход мыла.
1. В состав мыла вводят вещества-комплексообразователи, способствующие смягчению воды (натриевые соли этилендиамин-тетрауксусной кислоты – ЭДТК, ЭДТА, ДТПА).
2. В водных растворах мыло частично гидролизуется, т.е. взаимодействует с водой.
При этом образуется определенное количество щелочи, которая способствует расщеплению кожного сала и его удалению.
Калиевые соли высших карбоновых кислот (т.е. жидкое мыло) лучше растворяются в воде и поэтому обладают более сильным моющим действием.
Но при этом оказывает вредное воздействие на кожу рук и тела. Это связано с тем, что верхний тончайший слой кожи имеет слабокислую реакцию (рН =5,5) и за счет этого препятствует проникновению болезнетворных бактерий в более глубокие слои кожи. Умывание мылом приводит к нарушению рН, (реакция становится слабощелочная), раскрываются поры кожи, что приводит к понижению естественной защитной реакции. При слишком частом использовании мыла кожа сохнет, иногда воспаляется.
2. Для уменьшения данного негативного воздействия в современные сорта мыла добавляют:
– слабые кислоты (лимонная кислота, борная кислота, бензойная кислота и др.), которые нормализуют рН
– крема, глицерин, вазелиновое масло, пальмовое масло, кокосовое масло, диэтаноламиды кокосового и пальмового масел и т.д. для смягчения кожи и предотвращения попадания бактерий в поры кожи.
Возьмите чашку с водой. Поместите туда спичку так, чтобы она плавала на поверхности. Коснитесь заостренным концом мыла поверхности воды сбоку от спички. Спичка двигается в сторону от мыла. Это происходит потому, что поверхностное натяжение воды больше, чем мыльной. С разных сторон на спичку действуют разные силы – она движется в сторону от большей силы поверхностного натяжения. Поверхностный слой дистиллированной воды находится в натянутом состоянии подобно упругой пленке. При добавлении мыла и некоторых других растворимых в воде веществ поверхностное натяжение воды уменьшается. Мыло и другие моющие вещества относят к поверхностно-активным веществам (ПАВ). Они уменьшают поверхностное натяжение воды, усиливая тем самым моющие свойства воды
Строение мыла – стеарата натрия.
Молекула стеарата натрия имеет длинный неполярный углеводородный радикал (обозначен волнистой линией) и небольшую полярную часть:

Молекулы ПАВ на пограничной поверхности располагаются так, что гидрофильные группы карбоксильных анионов направлены в воду, а углеводородные гидрофобные выталкиваются из нее. В результате поверхность воды покрывается частоколом из молекул ПАВ. Такая водная поверхность имеет меньшее поверхностное натяжение, что способствует быстрому и полному смачиванию загрязненных поверхностей. Уменьшая поверхность натяжения воды, мы увеличиваем ее смачивающую способность.

СМС (синтетические моющие средства) – натриевые соли сложных эфиров высших спиртов и серной кислоты:

Синтетические моющие средства высвобождают сотни тысяч тонн пищевого сырья — растительных масел и жиров.
Можно сравнить мыла и СМС (стиральный порошок) проверив с помощью индикаторов, какая среда характерна для наших моющих средств.
При добавлении лакмуса в раствор мыла и в раствор СМС он приобретает синий цвет, а фенолфталеин – малиновый, то есть реакция среды щелочная. Кстати, если моющее средство предназначено для стирки хлопчатобумажных тканей, то реакция среды должна быть щелочной, а если для шелковых и шерстяных тканей – нейтральной.
А что происходит с мылом и СМС в жесткой воде?
Добавим в одну пробирку раствор мыла, а в другую раствор СМС, взболтаем их. Что вы наблюдаете? В эти же пробирки добавим хлорид кальция и взболтаем содержимое пробирок. Что вы наблюдаете теперь? Раствор СМС пенится, а в растворе мыла образуются нерастворимые соли:
СМС образуют растворимые соли кальция, которые также обладают поверхностно-активными свойствами.
Использование чрезмерного количества этих средств приводит к загрязнению окружающей среды.
Многие ПАВ трудно поддаются биологическому разложению. Поступая со сточными водами в реки и озера, они загрязняют окружающую среду. В результате образуются целые горы пены в канализационных трубах, реках, озерах, куда попадают промышленные и бытовые стоки. Использование некоторых ПАВ приводит к гибели всех живых обитателей в воде. Почему раствор мыла, попадая в реку или озеро, быстро разлагается, а некоторые ПАВ нет? Дело в том, что мыла, полученные из жиров, содержат неразветвленные углеводородные цепи, которые разрушаются бактериями. В то же время в состав некоторых СМС входят алкилсульфаты или алкил(арил)сульфонаты с углеводородными цепями, имеющими разветвленное или ароматическое строение. Такие соединения бактерии «переварить» не могут. Поэтому при создании новых ПАВ необходимо учитывать не только их эффективность, но и способность к биологическому распаду – уничтожению некоторыми видами микроорганизмов.